第一期“雙無(wú)”保健食品換證培訓(xùn)會(huì)熱點(diǎn)問(wèn)題匯總與解答!
2024-12-30
2024年12月20日,第一期“雙無(wú)”保健食品換證培訓(xùn)會(huì)在北京圓滿召開(kāi)。在培訓(xùn)會(huì)上,國(guó)家食品審評(píng)中心保健食品功能審評(píng)部主任劉洪宇對(duì)《在產(chǎn)在售“無(wú)有效期和無(wú)產(chǎn)品技術(shù)要求”保健食品集中換證審查要點(diǎn)》進(jìn)行了詳細(xì)解讀。此次培訓(xùn)會(huì)前,針對(duì)參會(huì)企業(yè)提出的具體咨詢問(wèn)題,食審中心進(jìn)行了集中梳理與解答,我們整理分享如下。

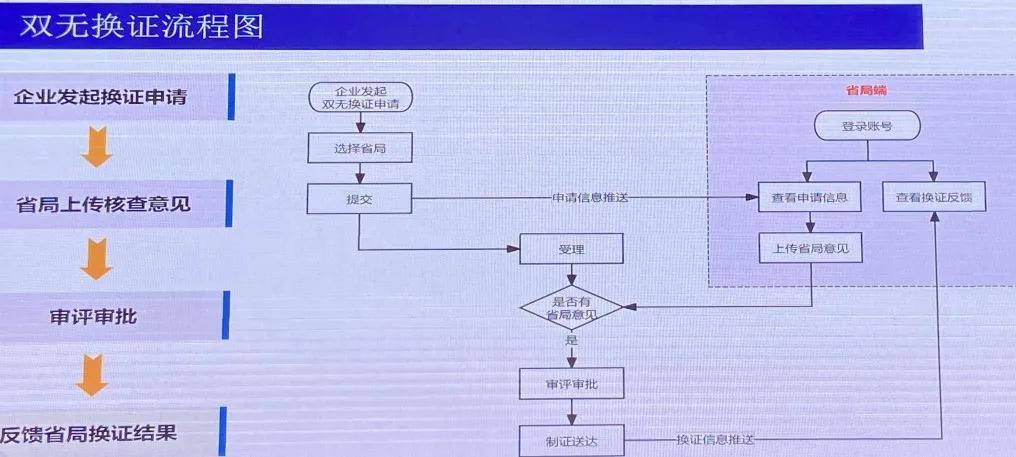
01、“雙無(wú)”保健食品換證流程
02、產(chǎn)品技術(shù)要求增訂指標(biāo)的,是只需要提供該指標(biāo)的穩(wěn)定性試驗(yàn),還是提供所有指標(biāo)穩(wěn)定性試驗(yàn)?
答:建議參照《保健食品注冊(cè)申請(qǐng)服務(wù)指南(2016年版)》產(chǎn)品穩(wěn)定性重點(diǎn)考察指標(biāo)和非穩(wěn)定性重點(diǎn)考察指標(biāo),以及注冊(cè)申請(qǐng)材料等相關(guān)要求。例如:增訂功效成分或標(biāo)志性成分指標(biāo)的,應(yīng)當(dāng)參照《指南》5.2.2.4(3)詳細(xì)說(shuō)明該功效成分或標(biāo)志性成分指標(biāo)選擇、指標(biāo)值制定及其檢測(cè)方法研究驗(yàn)證的過(guò)程和依據(jù),提供研究報(bào)告,以及三批樣品擬增訂功效成分或標(biāo)志性成分的穩(wěn)定性試驗(yàn)報(bào)告。
03、委托生產(chǎn)的產(chǎn)品,之前曾在多個(gè)省份或多家企業(yè)接受委托,是否需要所有省份的換證意見(jiàn)?
答:至少一家核發(fā)生產(chǎn)許可的省級(jí)市場(chǎng)監(jiān)管部門(mén)出具意見(jiàn),向合法生產(chǎn)許可的省局提出。
04、“雙無(wú)”產(chǎn)品批件未載明所有的原輔料、未載明工藝?
答:當(dāng)時(shí)的批件只載明主要原料,簡(jiǎn)單生產(chǎn)工藝。“雙無(wú)”換證根據(jù)省局換證意見(jiàn)核實(shí)的實(shí)際生產(chǎn)執(zhí)行的配方、工藝等進(jìn)行技術(shù)審查。
05、目前企業(yè)信用系統(tǒng)顯示申請(qǐng)人主體資質(zhì)異常,是否可以申請(qǐng)換證?
答:不影響受理。但是,建議盡快將企業(yè)狀態(tài)恢復(fù)正常,否則技術(shù)審評(píng)結(jié)束后,無(wú)法報(bào)批。
06、功能性食品中的營(yíng)養(yǎng)素限量,是否完全按照現(xiàn)行規(guī)定按照最低值等于標(biāo)簽標(biāo)識(shí)。考慮產(chǎn)品上市多年,消費(fèi)者無(wú)法理解法規(guī)變化引起標(biāo)簽改變,建議盡可能不做改變,此種情形維持現(xiàn)有標(biāo)識(shí)和標(biāo)準(zhǔn)限值?
答:《保健食品注冊(cè)申請(qǐng)服務(wù)指南》5.2.7項(xiàng),標(biāo)簽說(shuō)明書(shū)【功效成分或標(biāo)志性成分含量】應(yīng)包括成分名稱及含量。應(yīng)與產(chǎn)品技術(shù)要求中功效成分或標(biāo)志性成分指標(biāo)名稱一致,以產(chǎn)品技術(shù)要求中指標(biāo)最低值為標(biāo)簽說(shuō)明書(shū)標(biāo)示值。
07、原料不在原料目錄的營(yíng)養(yǎng)素補(bǔ)充劑是否在換證范圍?
答:《換證審查要點(diǎn)》“五、具體要求(四)”使用保健食品原料目錄內(nèi)原料的,若符合備案要求,確認(rèn)原注冊(cè)人身份后,轉(zhuǎn)備案管理。
08、一種新原料的安全評(píng)價(jià)是只做原料,還是只做產(chǎn)品,還是都做?
答:《換證審查要點(diǎn)》“五、具體要求(五)”,產(chǎn)品配方中含有保健食品新原料的,若原注冊(cè)時(shí)未提供原料安全性評(píng)價(jià)材料,也無(wú)法提供真實(shí)、可信、可溯源的上市后人群食用安全性評(píng)價(jià)報(bào)告,應(yīng)當(dāng)按照《保健食品及其原料安全性毒理學(xué)檢驗(yàn)與評(píng)價(jià)技術(shù)指導(dǎo)原則(2020年版)》(以下簡(jiǎn)稱指導(dǎo)原則)要求進(jìn)行新原料及產(chǎn)品的安全性評(píng)價(jià)及關(guān)聯(lián)審查。產(chǎn)品中含有2個(gè)及以上保健食品新原料的,還應(yīng)當(dāng)按照《指導(dǎo)原則》開(kāi)展產(chǎn)品90天經(jīng)口毒性試驗(yàn)和致畸試驗(yàn),并結(jié)合新原料食用歷史、使用情況、產(chǎn)品上市后人群食用安全性評(píng)價(jià)報(bào)告等綜合評(píng)估產(chǎn)品長(zhǎng)期食用的安全性。
09、技術(shù)要求:復(fù)方產(chǎn)品是否增補(bǔ)質(zhì)控指標(biāo)?
答:《換證審查要點(diǎn)》“五、具體要求(七)”,注冊(cè)人應(yīng)當(dāng)在備案或主動(dòng)公開(kāi)的執(zhí)行企業(yè)標(biāo)準(zhǔn)基礎(chǔ)上,研究制定符合現(xiàn)行規(guī)定和國(guó)家標(biāo)準(zhǔn)的產(chǎn)品技術(shù)要求。涉及增訂、修訂理化、微生物、功效成分/標(biāo)志形成指標(biāo)的,還需要提交修訂說(shuō)明以及相應(yīng)的衛(wèi)生學(xué)、穩(wěn)定性、功效成分/標(biāo)志性成分檢測(cè)等試驗(yàn)報(bào)告等材料。
10、實(shí)際生產(chǎn)工藝會(huì)要求與原申報(bào)工藝完全一致,如原申報(bào)資料一些具體參數(shù)沒(méi)有明確,增補(bǔ)后是否要補(bǔ)研究數(shù)據(jù),以及功能毒理試驗(yàn)?
答:《換證審查要點(diǎn)》“五、具體要求(七)”,根據(jù)注冊(cè)人的申請(qǐng),省級(jí)市場(chǎng)監(jiān)管部門(mén)出具的換證意見(jiàn),審評(píng)機(jī)構(gòu)按照現(xiàn)行規(guī)定將原輔料、生產(chǎn)工序及關(guān)鍵工藝參數(shù)、原料關(guān)聯(lián)審查信息等內(nèi)容納入注冊(cè)證書(shū)附件產(chǎn)品技術(shù)要求。
備注:換證申請(qǐng)的產(chǎn)品,是在產(chǎn)產(chǎn)品,省局換證意見(jiàn)提供產(chǎn)品實(shí)際生產(chǎn)工藝。原則上,不存在這類(lèi)“按已經(jīng)產(chǎn)生的結(jié)果,再去附和原因的”情況。絕對(duì)不支持“洗白”行為。
11、批文上的用量是一個(gè)范圍,如1-2g/天,是怎么規(guī)范?
答:按照《保健食品注冊(cè)申請(qǐng)服務(wù)指南》5.2.7項(xiàng),標(biāo)簽說(shuō)明書(shū)【食用量及食用方法】應(yīng)與產(chǎn)品配方配伍及用量的科學(xué)依據(jù)、安全性和保健功能試驗(yàn)評(píng)價(jià)材料等相符。
12、原申報(bào)時(shí)多劑型產(chǎn)品中副劑型產(chǎn)品,在雙無(wú)換證中是否需要補(bǔ)做毒理/功能實(shí)驗(yàn)?
答:《換證審查要點(diǎn)》“五、具體要求(七)”,同一產(chǎn)品包含多個(gè)劑型或食品形態(tài)的,若不影響產(chǎn)品質(zhì)量安全,維持原批準(zhǔn)的產(chǎn)品劑型或食品形態(tài)。同時(shí),對(duì)于安全性評(píng)估,按照《換證審查要點(diǎn)》五,具體要求(五)執(zhí)行。
13、歷史遺漏問(wèn)題出現(xiàn)申報(bào)資料與備案資料不一致問(wèn)題,變更以何為依據(jù)?
答:換證審查絕對(duì)不支持“洗白”行為。審查中,發(fā)現(xiàn)資料造假,未按照注冊(cè)配方工藝生產(chǎn)等行為,將核實(shí)后報(bào)總局處置。
14、標(biāo)準(zhǔn)可能需要調(diào)整,原標(biāo)準(zhǔn)制定不合理,系統(tǒng)填寫(xiě)技術(shù)要求是變更前還是變更后?
答:《換證審查要點(diǎn)》“五、具體要求(七)”,注冊(cè)人應(yīng)當(dāng)在備案或主動(dòng)公開(kāi)的執(zhí)行企業(yè)標(biāo)準(zhǔn)基礎(chǔ)上,研究制定符合現(xiàn)行規(guī)定和國(guó)家標(biāo)準(zhǔn)的技術(shù)要求。
15、如果需要調(diào)整配方工藝,如何調(diào)整?
答:可以參考審評(píng)中心網(wǎng)站關(guān)于“保健食品換證常見(jiàn)問(wèn)題及解答”。
16、批件上的原料現(xiàn)在是否面臨安全性問(wèn)題?
答:調(diào)整配方,參考《換證審查要點(diǎn)》“五(八)”;如不確定,《換證審查要點(diǎn)》“五、具體要求(五)”
17、增強(qiáng)免疫力功能不建議再補(bǔ)做,因?yàn)橘M(fèi)用太高
答:參考《新版功能目錄》解讀文件。
18、產(chǎn)品原名稱建議保留?
答:參考《換證審查要點(diǎn)》“五、具體要求(二)”
19、新原料定義是什么?
答:《保健食品注冊(cè)審評(píng)審批工作細(xì)則》3.4.2.2.1,保健食品新原料包括:(1)普通食品、新食品原料、“按照傳統(tǒng)既是食品又是中藥材的物質(zhì)”和“擬納入保健食品原料目錄”以外的原料;
?。?)普通食品、新食品原料、“按照傳統(tǒng)既是食品又是中藥材的物質(zhì)”和“擬納入保健食品原料目錄”中的物品,采用導(dǎo)致物質(zhì)基礎(chǔ)發(fā)生重大改變的工藝生產(chǎn)的原料。
20、產(chǎn)品功效成分指標(biāo):重新研究后下調(diào),可按下調(diào)后制定和變更?
答:《保健食品注冊(cè)申請(qǐng)服務(wù)指南》8.2,變更申請(qǐng)事項(xiàng)應(yīng)僅限批準(zhǔn)證書(shū)及其附件載明的內(nèi)容,且不得導(dǎo)致產(chǎn)品質(zhì)量發(fā)生實(shí)質(zhì)性改變。
21、如何理解衛(wèi)法監(jiān)發(fā)(2002)51號(hào)文中“如使用附件1、2之外的動(dòng)植物物品,個(gè)數(shù)不得超過(guò)4個(gè);使用附件1和附件2之外的動(dòng)植物物品或(原料),個(gè)數(shù)不得超過(guò)1個(gè)”這兩句話的關(guān)系,是必須同時(shí)滿足,還是滿足其中一個(gè)即可?
答:這是一句話,同時(shí)滿足。
22、因?yàn)闅v史問(wèn)題,有些品種在此次換證過(guò)程可能需要大量資金和時(shí)間去做很多補(bǔ)充研究,特別是配方調(diào)整,企業(yè)需要按照現(xiàn)行新產(chǎn)品要求重新論證安全性和保健功能和質(zhì)量可控。中心能否針對(duì)此類(lèi)情形,開(kāi)設(shè)提前溝通渠道,將審評(píng)向前段延伸,組織專(zhuān)家提前介入,為后續(xù)審評(píng)審批掃清障礙?
答:配方調(diào)整,按照新產(chǎn)品準(zhǔn)備全套資料。
23、2022年8月2日,食品審評(píng)中心再次發(fā)布“衛(wèi)生部關(guān)于進(jìn)一步規(guī)范保健食品原料管理的通知(衛(wèi)法監(jiān)發(fā)(2002)51號(hào))”,51號(hào)文中附件1既是食品又是藥品的物品名單,共有87種藥食同源的物質(zhì)。國(guó)家衛(wèi)生健康委員會(huì)同國(guó)家市場(chǎng)總局分別于2019年11月25日公告將當(dāng)歸、山奈、西紅花、草果、姜黃、蓽茇6種物質(zhì);2023年11月9日公告將黨參、肉蓯蓉、鐵皮石斛、西洋參、黃芪、靈芝、山茱萸、天麻。杜仲葉9種物質(zhì);2024年8月12日公告將地黃、麥冬、天冬、化橘紅4種物質(zhì)納入按照傳統(tǒng)既是食品又是中藥材的物質(zhì)目錄管理,是否可以理解后納入按照傳統(tǒng)既是食品又是中藥材的物質(zhì)目錄管理的19種物質(zhì)屬于附件1既是食品又是藥品的物品名單?
答:首先指出,食品審評(píng)中心沒(méi)有再次發(fā)布衛(wèi)法監(jiān)發(fā)(2002)51號(hào)的權(quán)限,中心外網(wǎng)是全文轉(zhuǎn)登,對(duì)于問(wèn)題,初步意見(jiàn)兩種情況:當(dāng)歸、山奈、西紅花、草果、姜黃、蓽茇6種物質(zhì),衛(wèi)健委公告“僅作為香辛料和調(diào)味品”,這個(gè)問(wèn)題需要組織討論明確;其他13種,原則上視為新增的食藥物質(zhì)。具體建議,“雙無(wú)”換證是變更申請(qǐng),按實(shí)際生產(chǎn)的配方工藝等技術(shù)要求提出申請(qǐng)。
24、關(guān)于換證期限:是5年換證期限到后企業(yè)必須完成上市“雙無(wú)”產(chǎn)品換證,必須獲得新批件?還是到期后只要企業(yè)提交了申請(qǐng)資料,尚未完成審評(píng)并獲得新證也還可以繼續(xù)生產(chǎn)
答:建議提早申報(bào)。
25、更換配方原料后,如調(diào)整產(chǎn)品名稱的,能否在新的產(chǎn)品名稱后括號(hào)內(nèi)標(biāo)注產(chǎn)品原名稱?
答:《換證審查要點(diǎn)》“五、具體要求(二)”,保留產(chǎn)品原名稱的,理由應(yīng)當(dāng)充分合理。調(diào)整產(chǎn)品名稱的,可在新的產(chǎn)品名稱后括號(hào)內(nèi)標(biāo)注原名稱,使用至本次換證證書(shū)有效期結(jié)束。
26、由于歷史原因,原配方研究時(shí)香精為“食用香精”,后期由于市場(chǎng)需求,在原薄荷味基礎(chǔ)上又開(kāi)發(fā)了西瓜味和話梅味兩款產(chǎn)品(配方其它原料完全相同),總共有三個(gè)口味,目前產(chǎn)品也上市20多年,消費(fèi)者遍及全國(guó),公司在產(chǎn)品功效和安全性方面也積累了較多的人體試食數(shù)據(jù)。雖與現(xiàn)行法規(guī)有不一致之處,想咨詢總局專(zhuān)家,在產(chǎn)品換證審批時(shí),考慮到歷史遺留問(wèn)題,如能補(bǔ)齊各口味產(chǎn)品安全評(píng)價(jià)、穩(wěn)定性等資料后,能否保留原該產(chǎn)品的三個(gè)口味,即換發(fā)三個(gè)保健食品文號(hào)。
答:建議在確定一個(gè)口味產(chǎn)品的基礎(chǔ)上,參照《保健食品申報(bào)與審評(píng)補(bǔ)充規(guī)定(試行)》關(guān)于“保健食品原料與主要輔料相同,涉及不同口味、不同顏色的產(chǎn)品”提出其它兩個(gè)口味產(chǎn)品的注冊(cè)申請(qǐng)。
27、成品指標(biāo)以及工藝是否按在產(chǎn)工藝申報(bào),原始申報(bào)材料遺失
答:省級(jí)局換證意見(jiàn)
28、有關(guān)注冊(cè)申報(bào)系統(tǒng)填報(bào)的問(wèn)題,產(chǎn)品配方:系統(tǒng)提示需確保與原批件一致。問(wèn)題:我們是益生菌產(chǎn)品,現(xiàn)行批件沒(méi)有菌株號(hào),按現(xiàn)行規(guī)定益生菌保健食品填報(bào)配方時(shí)需寫(xiě)上菌株號(hào),請(qǐng)問(wèn)系統(tǒng)填寫(xiě)配方時(shí)是否需寫(xiě)菌株號(hào)?
答:《益生菌類(lèi)保健食品申報(bào)與審評(píng)規(guī)定(試行)》第六條,申請(qǐng)益生菌類(lèi)保健食品,除按保健食品注冊(cè)管理有關(guān)規(guī)定提交申報(bào)資料外,還應(yīng)提供以下資料:(一)產(chǎn)品配方及配方依據(jù)中應(yīng)包括確定的菌種屬名、種名及菌株號(hào)...
29、關(guān)于現(xiàn)行規(guī)定修訂技術(shù)要求的,如申請(qǐng)人自查需要增訂/修訂某個(gè)指標(biāo),比如需要增訂“水分”指標(biāo),穩(wěn)定性試驗(yàn)請(qǐng)問(wèn)是只做“水分”,還是產(chǎn)品其它指標(biāo)都需一起做穩(wěn)定性考察?
答:換證審查要點(diǎn)》“五、具體要求(七)”,注冊(cè)人應(yīng)當(dāng)在備案或主動(dòng)公開(kāi)的執(zhí)行企業(yè)標(biāo)準(zhǔn)基礎(chǔ)上,研究制定符合現(xiàn)行規(guī)定和國(guó)家標(biāo)準(zhǔn)的產(chǎn)品技術(shù)要求。涉及增訂、修訂理化、微生物、功效成分/標(biāo)志形成指標(biāo)的,還需要提交修訂說(shuō)明以及相應(yīng)的衛(wèi)生學(xué)、穩(wěn)定性、功效成分/標(biāo)志性成分檢測(cè)等試驗(yàn)報(bào)告等材料。
30、關(guān)于產(chǎn)品實(shí)際工藝可能被認(rèn)為不符合現(xiàn)行生產(chǎn)許可要求的問(wèn)題:原產(chǎn)品是膠囊劑型,內(nèi)容物是供應(yīng)商已經(jīng)混好的混合粉,申請(qǐng)人購(gòu)入混合粉之后只進(jìn)行填充膠囊和包裝。請(qǐng)問(wèn)這種情況在換證時(shí),是否需要提出變更工藝的申請(qǐng),即申請(qǐng)人自行購(gòu)買(mǎi)各個(gè)原輔料,自行混合再裝膠囊
答:省局換證意見(jiàn)包括實(shí)際生產(chǎn)執(zhí)行的配方、工藝及技術(shù)要求。生產(chǎn)許可涉及違反《食品安全法》及其實(shí)施條例、《保健食品生產(chǎn)許可審查細(xì)則》等規(guī)定,“換證”工作無(wú)法開(kāi)展的,原則報(bào)總局處置。
31、關(guān)于“產(chǎn)品長(zhǎng)期食用的安全性論證報(bào)告”
答:《換證審查要點(diǎn)》附件3,產(chǎn)品上市后食用安全性報(bào)告,是指參照現(xiàn)行延續(xù)注冊(cè)要求,由注冊(cè)人(證書(shū)持有人)法人代表或授權(quán)簽字人簽字確認(rèn)的,產(chǎn)品上市銷(xiāo)售后開(kāi)展的質(zhì)量安全性投訴處置以及情況收集、處理過(guò)程結(jié)果等情況匯總報(bào)告以及產(chǎn)品上市銷(xiāo)售過(guò)程中是否涉及安全性問(wèn)題的結(jié)論性承諾。
《換證審查要點(diǎn)》附件2,產(chǎn)品上市后食用安全性報(bào)告,涉及需要對(duì)產(chǎn)品配方中原輔料進(jìn)行再確認(rèn)情形的,還應(yīng)當(dāng)相應(yīng)提交產(chǎn)品長(zhǎng)期食用的安全性論證報(bào)告(包括產(chǎn)品配方配伍和用量的理論依據(jù)、文獻(xiàn)依據(jù)等)、保健食品新原料安全性評(píng)價(jià)材料等。
32、產(chǎn)品配方是提取物,工藝是藥材投料提取,換證的話參考實(shí)際工藝?或者可否修改?
答:省局換證意見(jiàn)包括實(shí)際生產(chǎn)執(zhí)行的配方、工藝等技術(shù)要求。生產(chǎn)許可涉及違反《食品安全法》及其實(shí)施條例、《保健食品生產(chǎn)許可審查細(xì)則》等規(guī)定,“換證”工作無(wú)法開(kāi)展的,原則上報(bào)總局處置。
33、總固體檢測(cè)方法引用問(wèn)題:《藥典》酒劑要求測(cè)總固體,總固體指標(biāo)的檢測(cè)方法是否可以引用國(guó)家標(biāo)準(zhǔn),如GB/T13662-2018《黃酒》中的非糖固形物?!端幍洹分械墓绦挝锖繖z測(cè)方法存在可操作性差、檢測(cè)結(jié)果差異大的問(wèn)題
答:總固體指標(biāo)來(lái)源于藥典中的酒劑要求,而且藥典有明確的方法,建議執(zhí)行藥典方法。國(guó)標(biāo)里說(shuō)的都是固形物,跟總固體內(nèi)涵相似,但方法不同。
34、總黃銅檢測(cè)方法引用問(wèn)題:理化指標(biāo)的含量檢測(cè)方法是否一定要執(zhí)行《保健食品檢驗(yàn)與評(píng)價(jià)技術(shù)規(guī)范》?《保健食品檢驗(yàn)與評(píng)價(jià)技術(shù)規(guī)范》中總黃酮的含量檢測(cè)需要使用甲苯洗脫,2017年10月27日,世界衛(wèi)生組織國(guó)際癌癥研究機(jī)構(gòu)公布的致癌物清單初步整理參考,甲苯在3類(lèi)致癌物清單中,出于試驗(yàn)安全的考慮,能否考慮用企業(yè)標(biāo)準(zhǔn)執(zhí)行
答:《保健食品理化及衛(wèi)生指標(biāo)檢驗(yàn)與評(píng)價(jià)技術(shù)指導(dǎo)原則(2020年版)》總則,本指導(dǎo)原則第二部分提供的檢測(cè)方法為推薦方法,注冊(cè)申請(qǐng)人在對(duì)產(chǎn)品功效成分/標(biāo)志性成分檢測(cè)時(shí),應(yīng)選擇適合相應(yīng)產(chǎn)品的檢測(cè)方法,申請(qǐng)注冊(cè)檢驗(yàn)時(shí),應(yīng)提供該產(chǎn)品的配方、工藝、產(chǎn)品技術(shù)要求及功效成分/標(biāo)志性成分檢測(cè)方法以及檢測(cè)方法的適用性、重現(xiàn)性等方法學(xué)研究材料。檢測(cè)方法應(yīng)科學(xué)、適用、重現(xiàn)。
35、原技術(shù)要求指標(biāo)檢測(cè)方法列全文的是否開(kāi)展方法學(xué)?
答:企業(yè)應(yīng)確保檢測(cè)方法適用、重現(xiàn),以免監(jiān)督抽檢、風(fēng)險(xiǎn),職業(yè)打假時(shí)出現(xiàn)糾紛。
36、原批文未記載規(guī)格內(nèi)容,當(dāng)前在售的主力規(guī)格有125ml/瓶、258ml/瓶等多個(gè)規(guī)格,又有玻璃材質(zhì)、塑料材質(zhì)。對(duì)于多種規(guī)格、包裝材質(zhì),如果都想保留,企業(yè)無(wú)法確認(rèn)要針對(duì)規(guī)格+材質(zhì)的組合逐一開(kāi)展穩(wěn)定性試驗(yàn)
答:省級(jí)局換證意見(jiàn)明確實(shí)際生產(chǎn)情況
37、關(guān)于原批件保質(zhì)期為36個(gè)月的產(chǎn)品,如何實(shí)施穩(wěn)定性試驗(yàn)的問(wèn)題:按照現(xiàn)行保健食品穩(wěn)定性試驗(yàn)指導(dǎo)原則,超過(guò)24個(gè)月保質(zhì)期的產(chǎn)品應(yīng)采取長(zhǎng)期留樣模式開(kāi)展穩(wěn)定性試驗(yàn),企業(yè)時(shí)間層面的壓力較大(距離2028年只剩3年多時(shí)間)。是否能夠考慮先開(kāi)展一年留樣試驗(yàn),再用該樣品開(kāi)展3個(gè)月加速試驗(yàn),可以縮短一半的穩(wěn)定性試驗(yàn)時(shí)間,這一模式能否獲得認(rèn)可?或者有沒(méi)有其它可以縮短試驗(yàn)周期的穩(wěn)定性試驗(yàn)方案
答:“先開(kāi)展一年留樣,再用該樣品開(kāi)展3個(gè)月加速試驗(yàn),從而推出產(chǎn)品保質(zhì)期3年”不符合穩(wěn)定性試驗(yàn)指導(dǎo)原則,如涉及增訂指標(biāo)而需調(diào)整保質(zhì)期或開(kāi)展穩(wěn)定性試驗(yàn),建議開(kāi)展加速試驗(yàn),及早申報(bào)換證。同步開(kāi)展長(zhǎng)期保存試驗(yàn),數(shù)據(jù)完備后再申請(qǐng)延長(zhǎng)保質(zhì)期。
38、之前產(chǎn)品規(guī)格是100ml、150ml,企業(yè)希望2個(gè)規(guī)格都保存下來(lái),怎么申請(qǐng)?
答:省級(jí)局換證意見(jiàn)明確實(shí)際生產(chǎn)情況
39、沒(méi)有國(guó)標(biāo)、地標(biāo)或行標(biāo)的物料,但屬于地方常用食材,換證時(shí)是否可以繼續(xù)使用?如酸梅、余甘子、山葡萄等南方水果。如果可以,其質(zhì)量標(biāo)準(zhǔn)能否寫(xiě)成“應(yīng)質(zhì)好、無(wú)病蟲(chóng)害、無(wú)霉變、無(wú)雜質(zhì),并符合GB2762、GB2763的規(guī)定”?還是列表展開(kāi)?如果不可以,希望能夠明確,否則換證時(shí)可能會(huì)出現(xiàn)重做功能試驗(yàn)等情況,給企業(yè)造成較大經(jīng)濟(jì)損失
答:省級(jí)換證意見(jiàn)明確實(shí)際生產(chǎn)情況。中心外網(wǎng)問(wèn)答《保健食品產(chǎn)品技術(shù)要求常見(jiàn)問(wèn)題及注意事項(xiàng)》,原輔料質(zhì)量要求應(yīng)引用具有專(zhuān)屬性的質(zhì)量標(biāo)準(zhǔn),而非通用標(biāo)準(zhǔn)或使用標(biāo)準(zhǔn)。若無(wú)相關(guān)標(biāo)準(zhǔn),應(yīng)參考《保健食品注冊(cè)申請(qǐng)服務(wù)指南》5.2.2.4(5)制定。例如:蘋(píng)果粉不應(yīng)引用GB/T 29602《固體飲料》,大豆油不應(yīng)引用GB 2716《植物油》,某食品添加劑不應(yīng)引用GB 2760《食品添加劑使用標(biāo)準(zhǔn)》,復(fù)配原料不應(yīng)引用GB 26687《食品安全國(guó)家標(biāo)準(zhǔn)復(fù)配食品添加劑通則(含第1號(hào)修改單)》
40、雙無(wú)換證審評(píng)意見(jiàn)是3個(gè)月的補(bǔ)證時(shí)間嗎?建議放寬
答:執(zhí)行《保健食品注冊(cè)與備案管理辦法》。
41、申請(qǐng)換證是需要先去省局溝通還是先在國(guó)家局申請(qǐng)?
答:建議省局換證意見(jiàn)出具后,再提交換證申請(qǐng)。
42、換證目的是讓產(chǎn)品符合現(xiàn)行規(guī)定,按實(shí)際執(zhí)行的配方、工藝和技術(shù)要求生產(chǎn)吧?而大部分省局以原申報(bào)資料作為辦理生產(chǎn)許可證的前提,這可能導(dǎo)致企業(yè)只能按原申報(bào)資料中的配方、工藝等進(jìn)行換證?
答:省級(jí)局換證意見(jiàn)明確實(shí)際生產(chǎn)情況。
43、注冊(cè)人按照要求直接提出換證申請(qǐng),已受托生產(chǎn)企業(yè)也可以申請(qǐng)換證,有什么不同要求?現(xiàn)場(chǎng)核查按照新規(guī)范要求執(zhí)行還是可以簡(jiǎn)化程序?
答:注冊(cè)證書(shū)所有權(quán)與受托生產(chǎn)企業(yè)無(wú)關(guān),應(yīng)當(dāng)由注冊(cè)人申請(qǐng)換證,對(duì)資料存疑等情形,不排除開(kāi)展有因核查、注冊(cè)核查等措施。
44、老批文、在工藝、執(zhí)行標(biāo)準(zhǔn),相比目前的技術(shù)和工藝,顯得不適用,換證過(guò)程中是不是可以按照新技術(shù)來(lái),但和原批件工藝有差異,會(huì)不會(huì)受影響?
答:省局換證意見(jiàn)明確實(shí)際生產(chǎn)情況,對(duì)于工藝,換證后核發(fā)《產(chǎn)品技術(shù)要求》將納入主要工序和關(guān)鍵工藝及參數(shù),需要變更工藝,建議換證后申請(qǐng)變更。
45、“雙無(wú)”換證審評(píng)審批工作,換證申請(qǐng)人確保提交的申請(qǐng)材料與之相符,怎么銜接好“雙無(wú)”換證申請(qǐng)與省局出具換證意見(jiàn)相關(guān)環(huán)節(jié),具體時(shí)間和條件?
答:建議省級(jí)局換證意見(jiàn)已經(jīng)出具后,再提交換證申請(qǐng),請(qǐng)認(rèn)真核對(duì)申報(bào)資料,確保前后相符。
46、產(chǎn)品名稱咨詢:早年行業(yè)對(duì)硬質(zhì)糖果普遍采用拉條成型工藝,因而以“含片”命名的清咽硬質(zhì)糖果類(lèi)保健食品,普遍存在“溶化性”和“重量差異”兩項(xiàng)指標(biāo)達(dá)不到現(xiàn)行“含片”規(guī)定,我們也查到一些清咽同類(lèi)產(chǎn)品在延續(xù)注冊(cè)時(shí),審評(píng)專(zhuān)家可能考慮歷史原因,繼續(xù)保留“含片”名稱,沒(méi)有強(qiáng)制性要求改成“XX糖”。我們建議換證時(shí),審評(píng)專(zhuān)家能否也考慮到企業(yè)多年市場(chǎng)培育,繼續(xù)保留原名稱?
答:可按《審查要點(diǎn)》申請(qǐng)保留原名稱。
47、擬定的產(chǎn)品技術(shù)要求與企標(biāo)一致時(shí),是否要提供產(chǎn)品全項(xiàng)目穩(wěn)定性檢測(cè)報(bào)告等作為?
答:注冊(cè)人應(yīng)當(dāng)在備案或主動(dòng)公開(kāi)的執(zhí)行企業(yè)標(biāo)準(zhǔn)基礎(chǔ)上,研究制定符合現(xiàn)行規(guī)定和國(guó)家標(biāo)準(zhǔn)的產(chǎn)品技術(shù)要求。涉及增訂、修訂理化、微生物、功效成分/標(biāo)志形成指標(biāo)的,還需要提交修訂說(shuō)明以及相應(yīng)的衛(wèi)生學(xué)、穩(wěn)定性、功效成分/標(biāo)志性成分檢測(cè)等試驗(yàn)報(bào)告等材料。
48、雙無(wú)產(chǎn)品配方調(diào)整可以主動(dòng)替換或去除原料嗎?
答:注冊(cè)人按照現(xiàn)行規(guī)定調(diào)整產(chǎn)品配方(含替換或去除原料)的,按照現(xiàn)行新產(chǎn)品注冊(cè)要求提交產(chǎn)品配方、生產(chǎn)工藝、標(biāo)簽說(shuō)明書(shū)樣稿、產(chǎn)品技術(shù)要求等研發(fā)材料,安全性、保健功能、衛(wèi)生學(xué)、穩(wěn)定性、功效成分/標(biāo)志性成分檢測(cè)等試驗(yàn)報(bào)告,論證產(chǎn)品的安全性、保健功能和質(zhì)量可控性。替換或去除原料的,按新產(chǎn)品的申報(bào)要求和變更(換證)程序,進(jìn)行受理審評(píng)。
很多企業(yè)比較關(guān)心換證費(fèi)用和周期,這需要根據(jù)每個(gè)產(chǎn)品不同情況做出具體分析,費(fèi)用少則免費(fèi),多則幾十萬(wàn),周期少則幾個(gè)月,多則三四年。近幾年我們已幫助一些先行的企業(yè)進(jìn)行換證相關(guān)工作,以變更事項(xiàng)遞交,獲得寶貴的審評(píng)意見(jiàn)和經(jīng)驗(yàn),歡迎企業(yè)與我們交流,我們會(huì)對(duì)換證產(chǎn)品進(jìn)行全面評(píng)估和分析,提供經(jīng)濟(jì)、可行、保障的換證方案,依法合規(guī)、穩(wěn)步推進(jìn),從而確保5年內(nèi)順利換證!
